近日,我室李国辉研究员团队与上海交通大学医学院精准医学研究院雷鸣教授、武健教授团队合作,在揭示人类端粒DNA合成关键分子机制研究方面取得新进展。
端粒是位于真核生物染色体末端的DNA—蛋白复合体,用于保护染色体在细胞分裂过程中的完整性。端粒的DNA会随着细胞的每次分裂而逐渐缩短,一旦染色体末端端粒DNA消化殆尽,染色体将被降解或发生融合,细胞则会立即启动凋亡机制。因此,端粒被认为与细胞衰老密切相关,是人类抗衰老研究的重点。
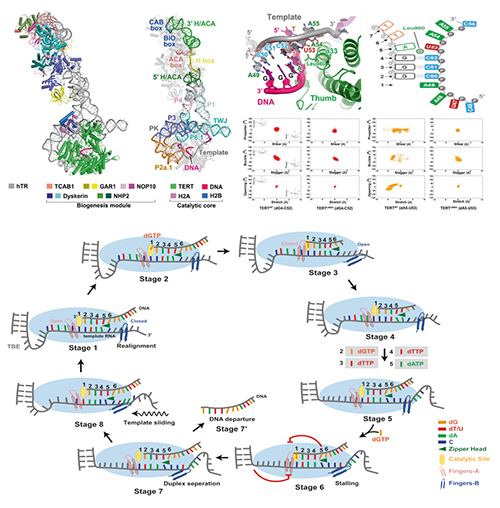
在细胞分裂的过程中,端粒酶也将被同时激活用于合成端粒DNA,以补偿端粒在该过程中的损失。人类端粒酶是一种具有逆转录酶活性的多亚基核糖核蛋白复合物,其功能缺失与人类多种端粒综合症有关,例如先天性角化不良(dyskeratosis congenita, DC)和小脑发育不全综合症(Hoyrara Hreidarsson syndrome,HHS)等。在传统逆转录酶合成DNA的过程中,引物DNA与RNA模版至少要保持6个以上碱基配对才能够开启DNA合成活性;而人类端粒酶仅需要3个碱基配对即可维持其端粒DNA的合成活性。
为了阐明上述重要过程的分子机理,本工作中,雷鸣和武健团队通过单颗粒冷冻电镜技术,解析了人类端粒酶全酶与端粒DNA引物和RNA模版杂合双螺旋的复合体结构。结合这些结构信息及李国辉团队深入的理论研究发现,人类端粒酶催化亚基中关键氨基酸Leu980在控制DNA-RNA杂合双螺旋配对长度调控方面具有关键作用。Leu980扮演着类似拉链头的作用,使底物DNA-RNA杂合双螺旋相对分离,且仅保持3个碱基配对的杂合状态。理论研究表明,将Leu980突变成Gly,可使DNA-RNA杂合双螺旋形成更紧密的6碱基配对构象。后续生化实验证实,Leu980Gly的突变将严重影响人类端粒酶持续和稳定的DNA合成能力。同时,理论方面动态结构信息分析表明,人类端粒酶中负责稳定杂合双螺旋底物两端手指结构域的反向协同构象互作,是端粒酶行使功能的重要结构特征。该工作为人类端粒酶重复合成端粒DNA的深入研究提供新的思路。
相关成果以“Zipper Head Mechanism of Telomere Synthesis by Human Telomerase”为题,于近日发表在《细胞研究》(Cell Research)上。该工作的共同第一作者是上海交通大学医学院万福堂博士后、中科院上海生化与细胞研究所丁勇博博士、我室1106组张跃斌副研究员、上海交通大学医学院吴振芳副教授。上述工作得到国家自然科学基金、国家重点研发计划等项目的支持。(文/图 张跃斌、李国辉)
文章链接: https://doi.org/10.1038/s41422-021-00586-7