近日,我室李国辉研究员团队与中国科学院分子细胞科学卓越创新中心(上海生物化学与细胞生物学研究所)杨巍维研究员团队、广州大学王雄军教授、复旦大学附属中山医院李全林教授等合作,揭示了代谢酶果糖1,6-二磷酸酶1(FBP1)能够行使蛋白磷酸酶的功能,并证明了FBP1介导的IκBα去磷酸化在结直肠癌发生中起到关键作用。
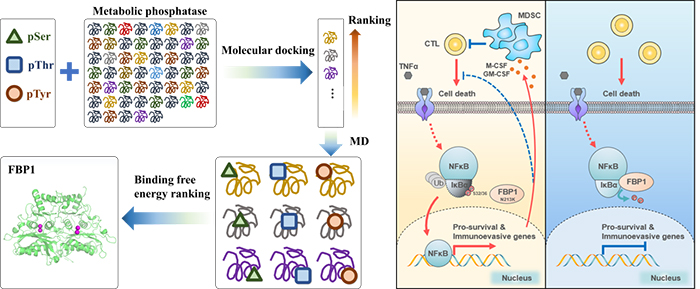
有研究表明,磷酸化可溶性代谢物的代谢酶,也可以作为蛋白质激酶磷酸化各种蛋白质底物,进而调节细胞周期、细胞凋亡和许多其他的细胞过程。合作团队针对这一研究现象,拟先通过理论计算挖掘可作为蛋白质去磷酸化的代谢物磷酸酶。李国辉团队通过分子对接和分子动力学(MD)模拟对57种代谢物磷酸酶进行了高通量筛选,发现糖异生途径中的催化果糖1,6-二磷酸(F-1,6-BP)水解为果糖6-磷酸(F-6-P)的关键代谢酶FBP1,可作为蛋白质磷酸酶。鉴于此,实验合作团队进一步通过磷酸化蛋白质组学分析,确定了IκBα是FBP1去磷酸化的蛋白底物。研究发现,FBP1第213位天冬酰胺(N213)直接与IκBα相互作用并去磷酸化IκBα第32/36位丝氨酸(S32/36),从而抑制NF-κB信号的激活。量子化学计算结果显示,FBP1介导的IκBα去磷酸化的催化机制与F-1,6-BP去磷酸化类似, IκBα去磷酸化的能垒高于其底物。
该工作不仅揭示了代谢酶FBP1能够行使蛋白磷酸酶的功能,明确了IκBα是FBP1去磷酸化的蛋白质底物,并确立了FBP1介导的IκBα去磷酸化在结直肠肿瘤发生中的关键作用及其机制。
相关研究以“Fructose-1,6-bisphosphatase 1 dephosphorylates IκBα and suppresses colorectal tumorigenesis”为题,于近日发表在《细胞研究》(Cell Research)上。该工作的第一作者是分子细胞卓越中心朱文成博士、我室楚慧郢副研究员、分子细胞卓越中心张亚娟副研究员、上海长海医院罗天航主任医师、广州大学喻华博士。以上工作得到了中科院B类先导专项“生物大分子复合体结构与功能的跨尺度研究”、国家自然科学基金等项目的支持。(文/图 楚慧郢、李国辉)
原文链接:https://www.nature.com/articles/s41422-022-00773-0